2019 届高中三年级第二学期教学调查化学试题
相对原子水平:H-1 C-12 N-14 Na-23 Si-28 O-16 Cl-35.5
第 Ⅰ 卷
1、选择题(每小题只有一个正确选项,每题 2 分,共 40 分)
2019.03
1. 化石燃料燃烧生成的 SO2 与 O2 接触会部分转化为 SO3,反应过程中“飘尘”所起有哪些用途可能是( )
A. 氧化 B. 催化 C. 还原 D. 冷凝
2. 下列过程中发生化学变化的是( )
A. 海水晒盐 B. 工业制取 N2 C. 干冰人工降雨 D. 漂粉精消毒
3. 中国向世界作出碳减排承诺,2020 年比 2005 年降 40-45%,下列做法有益于碳减排的是( )
A. 用家用汽车代替公交车 |
| B. 能源结构以煤炭为主 |
C. 纯碱工业中二氧化碳循环用 |
| D. 广泛用酒精和沼气 |
4. 下列过程中,共价键被破坏的是( | ) |
|
A. 碘升华 |
| B. 溴蒸气被木炭吸附 |
C. 酒精溶于水 |
| D. 氯化氢气体溶于水 |
5. 下列化学用语正确的是( ) |
|
|
A. 乙烯的结构简式 CH2CH2 B. 氯化铵的电子![]()
C. 氟原子的结构示意![]() D. 氧离子的轨道表示
D. 氧离子的轨道表示![]()
6. 下列有机物命名正确的是( )
 A.
A. ![]() 2-甲基丙醇 B.
2-甲基丙醇 B. ![]() 2-乙基—1—丁烯
2-乙基—1—丁烯
C. 2-二氯丙烷 D. ![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
7. 以下试剂不可以辨别 HCl 和 SO2 的是( )
A. NaOH 溶液 B. 氢硫酸溶液 C. 溴水 D. 品红溶液
8. 有关实验现象叙述错误的是( )
A. 硫蒸汽与 H2 混合生成 H2S
B. NH3 使含酚酞的水溶液变红,加热后又恢复到无色
C. NH4Cl 固体受热会发生升华
D. 浓硝酸久置后颜色会变黄
9. 阿伏伽德罗常数可用NA 表示,下列叙述中正确的是( )
A. 1molH2O 所含的原子数为NA 个
B. 16gO2-含有些电子数为 10 NA 个
C. 常温常压下,11.2LCl2 所含分子数为 0.5 NA 个
D. 1L 1mol/LNaClO 溶液中含 ClO-个数为NA 个
10. 分别含有下列各物质的废弃试剂,倒在同一废液缸中不会引起实验室污染或危险的一组是( )
A. 氨水和 NaOH B. 硫酸铵和氯化钡
C. 硝酸亚铁和盐酸 D. 电石和盐酸
11. 等量的铁粉分别与足量的盐酸、水蒸气在肯定的条件下充分反应,则在相同的条件下,产生氢气的物质的量之比是( )
A. 1:1 B. 3:4 C. 2:3 D. 4:3
12. 由 N2O 和 NO 反应生成 N2 和 NO2 的能量变化如图所示,下列说法错误的是( )
A.  用催化剂可以减少过渡态的能量
用催化剂可以减少过渡态的能量
B. 反应物总能量大于生成物总能量
C. 反应的热化学方程式为 N2O+NO→N2+NO2+139kJ
D. 用催化剂可提升 N2O 和 NO 的实际转化的比例
13.
青蒿素对热不稳定,国内诺贝尔获得者屠呦呦用沸点较低的乙醚在 60℃下从青蒿中提取青蒿素步骤如下:
步骤中涉及的实验装置为( )
 |
14. S-诱抗素的结构如图,下列关于 1mol 该分子性质叙述错误的是( )
A.  最多与 3molH2 反应
最多与 3molH2 反应
B. 与 Na 反应最多生成 1mol 氢气
C. 能使酸性 KMnO4 和溴水褪色
D. 最多与 2molNaOH 反应
15. 电解滴有石蕊的饱和食盐水 a,以下判断正确的是( )
A.  电解时化学能转变为电能
电解时化学能转变为电能
B. Y 极附近最后变为红色
C. 电子流向:X→负极→正极→Y
D. 电解一段时间两极采集的气体体积:X 极>Y 极
16. 工业制备硫酸接触室的反应 2SO2+O2 ƒ2SO3+Q,下列说法正确的是( )
A. 生成的 SO3 在吸收塔中用水吸收 B. 离别出 SO3 对正反应的反应速率影响大
C. 接触室中装配热交换器来充分借助能源 D. 工业上选择高压、低温做到又快又好
17.
 |
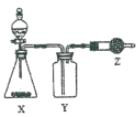 |
右图是用于制取、采集并吸收多余气体的装置,下列策略正确的是( )
18. 今有甲、乙、丙三瓶等体积的新制的氯水,浓度均为 0.1mol∙L-1。假如在甲瓶中加入少量的 NaHCO3 晶体(m mol),在乙瓶中加入少量 NaHSO3(m mol),丙瓶不变,一会儿后甲、乙、丙三瓶溶液中 HClO 的物质的量的浓度大小关系是(溶液体积变化忽视不计)( )
A. 甲=乙>丙 B. 甲>乙>丙 C. 丙>甲=乙 D. 甲>丙>乙
19. 下列化学反应可以用离子反应:Ba2++2HCO3-+2OH-→BaCO3 ¯ +CO32-+2H2O 表示的是( )
A. Ba2 与少量的 NaHCO3 B. Ba2 与少量的 Ba2
C. Ba2 与足量的 NaOH D. Ba2 与足量的 Ba2
20. 100mL 含有 0.20mol 碳酸钠的溶液和 200mL 盐酸,不管将前者滴加入后者,还是将后者滴加入前者, 都有气体产生,但最后生成的气体体积不同,则盐酸的浓度适当的是( )
A. 0.18mol/L B. 0.24mol/L
C. 1.5mol/L D. 2.0mol/L
第 Ⅱ 卷
2、(本题共 14 分)
氮化硅(Si3N4)是一种要紧的陶瓷材料,可用石英与焦炭在 1400~1450℃的氮气氛围下合成:
3SiO +6C+2N ˆˆ高ˆ温†ˆ Si N +6CO-Q
2 2 ‡ˆˆˆ 3 4
在肯定条件下,向 10L 密闭容器中加入反应物,10min 后达到平衡。完成下列填空:
21. 上述反应所涉及的元素,原子半径由大到小的顺序是____________________。其中一种元素的原子核外 s
电子数与 p 电子数相等,写出它的核外电子排布式____________________。
22. 上述反应混合物中的极性分子是____________________,写出非极性分子的电子式____________________。剖析用氮化硅制造轴承和发动机中耐热部件是什么原因:
23. 下列手段可以提升二氧化硅实际转化的比例的是____________________(选填编号)。
a. 增加焦炭用量 b. 升高反应温度
c. 增大方体压强 d. 向反应容器中多充入氮气
24. 下列描述中能说明反应已达平衡的是____________________(选填编号)。
a. c=3c b. v=3v
c. 容器内气体的密度不变 d. 气体的压强维持不变
25. 该反应的平衡常数为______________________________,平衡后增加氮气浓度,平衡向____________________(填“正反应”或“逆反应”) 方向移动,K 值____________________(填“变大”“变小”或“不变”)。若测得平衡时气体水平增加了 11.2g,则用 氮气表示的平均反应速率为______________________________。
3、(本题共 14 分)
含硫化合物在生产日常有广泛应用,其吸收处置也十分要紧。
26. 完成并配平下列离子方程式。
____________________Fe3++____________________SO2+____________________→____________________Fe2++____________________SO42-+____________________
27. 标明电子转移的方向和数目:____________________Fe3++____________________SO2……。
28. 在 Na2SO3 溶液中滴加酚酞,溶液呈红色,若在该溶液中滴入过量的 BaCl2 溶液,实验现象为:
____________________。请结合离子方程式,运用平衡原理进行讲解
____________________。
29. 在 NaClO 溶液中通入 SO2,写出反应的离子方程式:____________________。
30. 在 0.1mol/L Na2SO3 溶液中,下列关系式正确的是____________________。
a. [Na+]+[H+]=[SO32-]+[HSO3-]+[OH-] b. [Na+]>[SO32-]>[OH-]>[H+]
![]() c. [Na+]=2[SO3 ]+2[HSO3 ]+2[H2SO3] d. [Na ]=2[SO3 ]>[OH ]=[H ]
c. [Na+]=2[SO3 ]+2[HSO3 ]+2[H2SO3] d. [Na ]=2[SO3 ]>[OH ]=[H ]
c
![]()
![]() 向该溶液中加入少量 Na2SO3 固体,
向该溶液中加入少量 Na2SO3 固体,
![]() c
c
(填“增大”“减小”或“不变”)。
4、(本题共 14 分)
硫代硫酸钠(Na2S2O3)俗称保险粉,可用作照相定影剂、纸浆漂白脱氯剂等。
31. 实验室可通过反应 2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2 制取 Na2S2O3,装置如图所示:
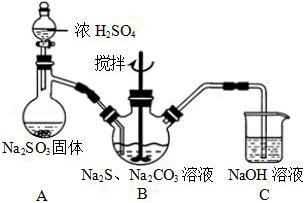 |
装置 B 中搅拌器有哪些用途是____________________;装置 C 中 NaOH 溶液有哪些用途是____________________。
32. 请对上述装置提出一条优化手段____________________。
为测定所得保险粉样品中 Na2S2O3·5H2O 的水平分数,称取 3.000gNa2S2O3·5H2O 样品配成 100mL 溶液,用 0.100mol/L 标准碘溶液进行滴定,反应方程式为:
2Na2S2O3+I2→2NaI+Na2S4O6
33. 滴定时用____________________作指示剂,滴定时用的主要玻璃仪器有____________________。
34. 滴定时,若看到溶液局部变色就停止滴定,则样品中 Na2S2O3·5H2O 的水平分数测定值____________________(填“偏高”、“偏低”或“不变”)。
35. 某学生小组测得实验数据如下:
实验次数 | 样品溶液体积(ml) | 滴定消耗 0.100mol/L 碘溶液体积(ml) |
1 | 20.00 | 9.80 |
2 | 20.00 | 10.70 |
3 | 20.00 | 9.90 |
该样品中 Na2S2O3·5H2O 的水平分数是____________________(精准到 0.001)。5、(本题共 18 分)
具备支链的芳香族化合物是要紧的化工材料和合成中间体,以下是由丙烯为材料合成油墨材料 DAP-A
树脂的步骤。
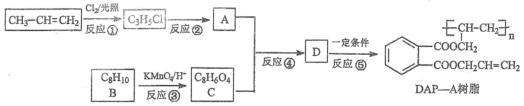
已知:烯烃与氯气在不同条件时,反应种类不同。完成下列填空:
36. 写出⑤的反应种类____________________;写出④的反应试剂和反应条件____________________。
37. 写出结构简式 A____________________ B____________________。
38. 写出反应的化学方程式。
反应②____________________
反应④____________________
39. 写出 C 在肯定条件下与乙二醇发生反应生成一种高分子化合物的结构简式____________________;写出一种符合 系列需要 C 的同分异构体的结构简式____________________。
①芳香族化合物 ②能发生水解 ③能与 NaHCO3 反应 ④苯环上有两种不同化学环境的氢原子
40. 以乳酸为单体制备的高分子材料聚乳酸具备易生物降解、耐热性好、抗菌、阻燃等特征,作用与功效广泛。请写出以丙烯为材料制备乳酸(2-羟基丙酸)的合成路线。
参考答案
1、选择题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
B | D | C | D | D | B | A | C | B | B |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
B | D | C | D | D | C | A | D | C | A |
2、21. Si>C>N>O;1s22s22p4
CO;![]() ;氮化硅是原子晶体、熔点高
;氮化硅是原子晶体、熔点高
bc
cd
25. [c]6/[c]2;正反应;不变;0.002mol/
3、26. 2Fe3++SO2+2H2O→2Fe2++SO42-+4H+
略
![]()
![]() 产生白色沉淀,且红色褪去;在 Na2SO3 溶液中,SO32-水解 SO3 +H2O⇌ HSO3 +OH ,加入 BaCl2 后, Ba2++SO3 →BaSO3↓(白色),因为 c(SO3 )减小,SO3 水解平衡左移,c(OH )减小,酚酞褪色
产生白色沉淀,且红色褪去;在 Na2SO3 溶液中,SO32-水解 SO3 +H2O⇌ HSO3 +OH ,加入 BaCl2 后, Ba2++SO3 →BaSO3↓(白色),因为 c(SO3 )减小,SO3 水解平衡左移,c(OH )减小,酚酞褪色
![]() ClO-+SO2+H2O→Cl-+SO4 +2H
ClO-+SO2+H2O→Cl-+SO4 +2H
bc
4、31. 让反应物充分反应(或反应物充分混合或加快反应速度);吸收二氧化硫尾气,预防空气污染
32. A 中分液漏斗改为恒压漏斗,或者 BC 之间添加一个安全瓶防倒吸(合理即可)
33. 淀粉; 滴定管、锥形瓶 34. 偏低 35. 0.814
5、36. 聚合反应;浓硫酸、加热
![]() CH2=CH-CH2OH;
CH2=CH-CH2OH;
![]() CH2=CHCH2Cl+NaOH ¾H¾2O¾®CH2=CHCH2OH+NaCl
CH2=CHCH2Cl+NaOH ¾H¾2O¾®CH2=CHCH2OH+NaCl
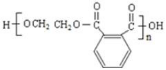
![]() 39. ;
39. ;
 40.
40.







